Δομές χορηγών αποκαλύπτουν πώς οι πρωτεΐνες αποτρέπουν ασθένειες από κακή αναδίπλωση
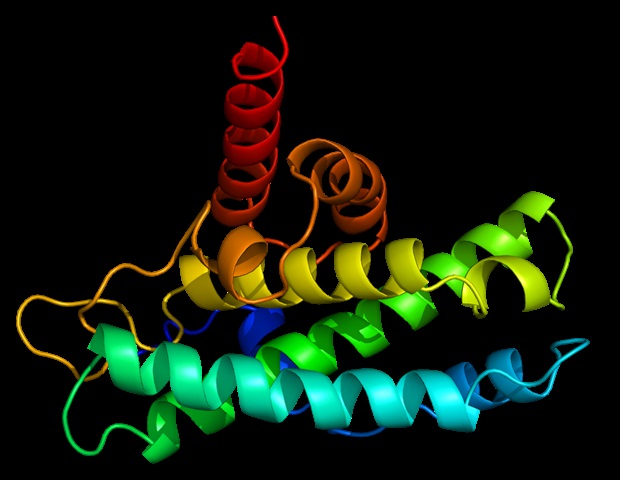
Η πρώτη πλήρης δομή δύο πρωτεϊνών χορηγών θερμικού σοκ σε σύμπλεγμα αποκαλύπτει την κρίσιμη δομική περιοχή που ρυθμίζει τη λειτουργία τους, σύμφωνα με νέα μελέτη από το Ερευνητικό Νοσοκομείο St. Jude. Το σύμπλεγμα χορηγών συνδέεται με κακώς αναδιπλωμένες πρωτεΐνες και τους δίνει μια δεύτερη ευκαιρία να αναδιπλωθούν σωστά. Αυτή η διαδικασία είναι ζωτικής σημασίας για τα κύτταρα, καθώς οι ακατάλληλα αναδιπλωμένες πρωτεΐνες τείνουν να συσσωρεύονται, κάτι που μπορεί να προκαλέσει μια ποικιλία ασθενειών. Ωστόσο, ο μηχανισμός με τον οποίο αυτές οι δύο κύριες πρωτεΐνες χορηγών θερμικού σοκ, Hsp40 και Hsp70, συνδέονται μεταξύ τους και με τις κακώς αναδιπλωμένες πεπτίδες παρέμενε ασαφής. Οι νέες δομές επέτρεψαν στους επιστήμονες να κατανοήσουν πώς λειτουργεί η κυτταρική μηχανή. Τα ευρήματα δημοσιεύθηκαν σήμερα στο περιοδικό Molecular Cell.
Η σημασία των χορηγών θερμικού σοκ
“Οι πρωτεΐνες χορηγών θερμικού σοκ αποτελούν την πρώτη γραμμή άμυνας κατά της κακής αναδίπλωσης και της συσσώρευσης πρωτεϊνών, που είναι προάγγελοι πολλών ασθενειών”, δήλωσε ο κύριος συγγραφέας της μελέτης, Δρ. Χαράλαμπος Μπάμπης Καλοδήμος, πρόεδρος του Τμήματος Δομικής Βιολογίας του St. Jude.
“Δείξαμε πώς αυτές οι δύο συγκεκριμένες πρωτεΐνες χορηγών θερμικού σοκ συνεργάζονται, αποκαλύπτοντας μια προηγουμένως άγνωστη σειρά μηχανισμών που εξηγούν πώς λειτουργούν σε tandem και πώς μπορεί να συμβεί κακή λειτουργία τους.” Οι χορηγοί θερμικού σοκ είναι απαραίτητοι σε σχεδόν όλους τους οργανισμούς, με παρόμοιες εκδόσεις να υπάρχουν από τα βακτήρια μέχρι τους ανθρώπους. Οι βακτηριακές Hsp40 και Hsp70 είναι γνωστό ότι βοηθούν τις κακώς αναδιπλωμένες πρωτεΐνες να αναδιπλωθούν σωστά, με δεκαετίες έρευνας να έχουν επικεντρωθεί στη λειτουργία τους ως χορηγών πρωτεϊνών. Οι ανθρώπινες εκδόσεις αυτών των πρωτεϊνών συνδέονται επίσης με πολλές ασθένειες. Ωστόσο, πώς ακριβώς οι Hsp40 και Hsp90 συνδέονται με μια πελάτισσα πρωτεΐνη και μεταξύ τους παρέμενε άγνωστο, καθώς κανείς δεν είχε καταφέρει να ξεπεράσει τα τεχνικά εμπόδια που σχετίζονται με την καταγραφή της μαζικής πλήρους δομής.
Συνδυασμένες μέθοδοι για την αποκάλυψη δομών
Αντί να χρησιμοποιήσουν μια μόνο προσέγγιση, οι επιστήμονες του St. Jude συνδύασαν κρυογονική ηλεκτρονική μικροσκοπία, απεικόνιση πυρηνικού μαγνητικού συντονισμού και δεδομένα ακτίνων Χ κρυσταλλογραφίας για να λύσουν τελικά τη δομή του βακτηριακού συμπλέγματος. Κατέγραψαν πολλές μορφές της δομής, που αποτελούνταν από δίμερες (ζεύγη) Hsp70 που αλληλεπιδρούν με δίμερες Hsp40, σε διάφορες καταστάσεις σύνδεσης με πελάτισσες πρωτεΐνες. “Το πιο σημαντικό, καταγράψαμε τις πλήρεις δομές των ενεργών και ανασταλμένων καταστάσεων, συνδεδεμένες με μια κακώς αναδιπλωμένη πρωτεΐνη”, δήλωσε ο Καλοδήμος. “Αλλά λύσαμε επίσης πολλές μικρότερες κομμάτια. Συγκεντρώνοντάς τα μαζί, μας έδωσαν ένα νέο μοντέλο για το πώς λειτουργεί πραγματικά το σύμπλεγμα Hsp40 και Hsp70.”
Μεταλλάξεις σε μια συγκεκριμένη περιοχή της Hsp40 σχετίζονται με μια σειρά παθήσεων, συμπεριλαμβανομένων πολλών νευροεκφυλιστικών ασθενειών, αλλά πώς αυτές οι μεταλλάξεις διαταράσσουν τις κανονικές λειτουργίες παρέμενε άγνωστο. Η περιοχή είναι πλούσια σε εξαιρετικά διατηρημένα αμινοξέα που ονομάζονται γλυκίνες και φαινυλαλανίνες, αν και οι ακριβείς τους λειτουργίες δεν ήταν σαφείς. Οι δομές αποκάλυψαν ότι αυτή η περιοχή της Hsp40 συνδέεται πρώτα με μια πελάτισσα πρωτεΐνη, και στη συνέχεια μια συγκεκριμένη φαινυλαλανίνη συνδέεται με την περιοχή σύνδεσης υποστρώματος στην Hsp70. Αυτή η φαινυλαλανίνη στη συνέχεια τραβά την κακώς αναδιπλωμένη πρωτεΐνη στην περιοχή σύνδεσης υποστρώματος, απομακρύνοντάς την από τη θέση, αν και το υπόλοιπο της Hsp40 παραμένει συνδεδεμένο με την Hsp70. Μετά τη μεταφορά, η κακώς αναδιπλωμένη πεπτίδα αναδιπλώνεται από την Hsp70.
“Ανακαλύψαμε πρώτα τον μηχανισμό μεταφοράς, όπου η Hsp40 δίνει την πελάτισσα στην Hsp70, αρχικά εισάγοντας μια φαινυλαλανίνη στην κοιλότητα σύνδεσης, που στη συνέχεια μεταφέρει την πελάτισσα στην ίδια θέση”, δήλωσε ο Καλοδήμος. “Αλλά, έχοντας δομές του συμπλέγματος σε πολλές καταστάσεις, είδαμε επίσης πώς το σύμπλεγμα απελευθερώνει τις πελάτισσες πρωτεΐνες.” Οι επιστήμονες διαπίστωσαν ότι όταν η ATP, το ενεργειακό νόμισμα του κυττάρου, συνδέεται με την Hsp70, η Hsp70 αλλάζει σχήμα, ωθώντας τη φαινυλαλανίνη πίσω στην κοιλότητα σύνδεσης, η οποία με τη σειρά της ωθεί την πελάτισσα πρωτεΐνη και την απελευθερώνει στο κύτταρο. Μετά, η Hsp40 απομακρύνεται από την Hsp70 και είναι διαθέσιμη να συνδεθεί με μια άλλη κακώς αναδιπλωμένη πρωτεΐνη, ξεκινώντας ξανά τη διαδικασία.
“Τώρα κατανοούμε μηχανιστικά πώς οι χορηγοί και οι πρωτεΐνες…”